Забава детства. Так многие вспоминают о карбиде, особенно бывшие мальчишки, а ныне, конечно, взрослые мужчины. Они брали камешки на строительных рынках. Покупать не покупали, а так, таскали с развалов и из кузовов грузовиков.
Добычу клали в бутылки, заливали водой, закрывали, встряхивали. Оставалось кинуть тару и полюбоваться взрывом. Любовались и белесыми пузырями, которые карбид давал, попадая в лужи. Однако, кому обязаны таким весельем, сорванцы прошлых лет, зачастую не знали.
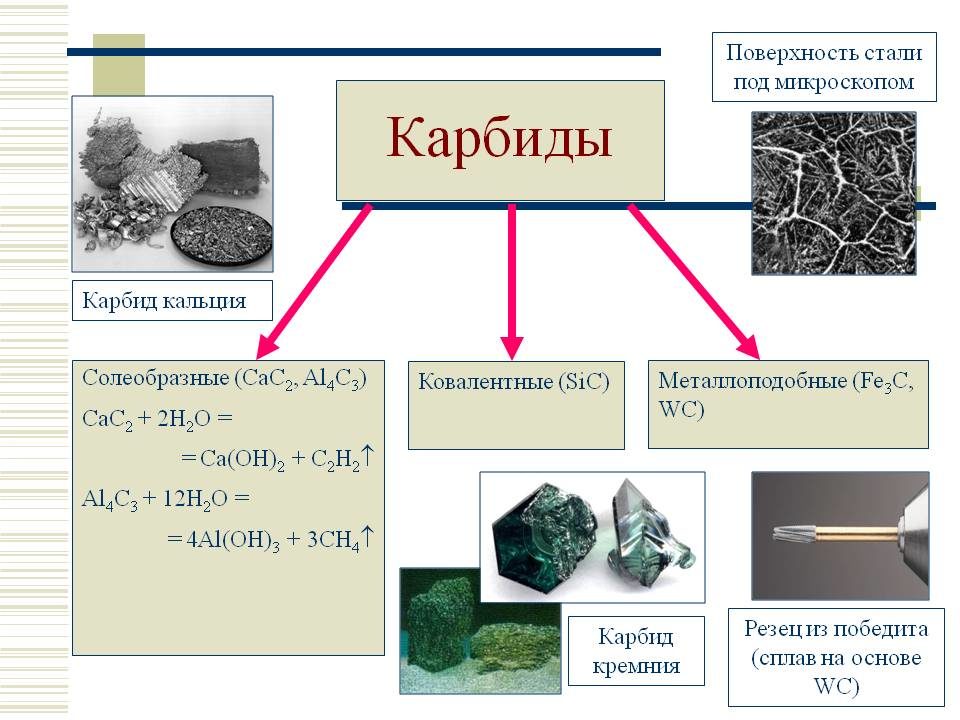 Карбид (от лат. carbo — уголь), соед. углерода с металлами, а также с бором и кремнием. По типу хим. связи К. делят на ионные (солеобразные), ковалентные и металлоподобные (ионно-ковалентно-металлические). Ионные К. (см. табл. 1) образуют металлы I и II гр. (соотв. М 2 С 2 и МС 2), РЗЭ и актиноиды (МС, М 2 С 3, МС 2), а также Аl. В этих соед. атом С в зависимости от типа гибридизации ( или sp) образует ионы С 4-, (C=C4-, (С=С=С)4-, (C=C)2-.
Карбид (от лат. carbo — уголь), соед. углерода с металлами, а также с бором и кремнием. По типу хим. связи К. делят на ионные (солеобразные), ковалентные и металлоподобные (ионно-ковалентно-металлические). Ионные К. (см. табл. 1) образуют металлы I и II гр. (соотв. М 2 С 2 и МС 2), РЗЭ и актиноиды (МС, М 2 С 3, МС 2), а также Аl. В этих соед. атом С в зависимости от типа гибридизации ( или sp) образует ионы С 4-, (C=C4-, (С=С=С)4-, (C=C)2-.
Ковалентные К. (см. табл. 2) образуют В и Si; атом С в этих соед. находится в состоянии и sp3 -гибридизации. Металлoподобные К. образуют переходные металлы IV-VII гр., Со, Ni и Fe. В этих К. связь металл-углерод ионно-ковалентная, причем атом С отрицательно заряжен, связь металл — металл чисто металлическая, атомы С между собой не связаны.
К. щелочных металлов кристаллизуются в решетках типа графита, атомы металлов размещаются между углеродными слоями, построенными из гексагoн. сеток. К. щел.-зем. металлов кристаллизуются в гранецентрир. тетрагон. решетке типа СаС 2, карбиды РЗЭ, монокарбиды актиноидов и переходных металлов в гранецентрир. кубической типа NaCl, сесквикарбиды актиноидов М 2 С 3 в объемноцентрир. кубич. решетке типа Рu2 С 3.
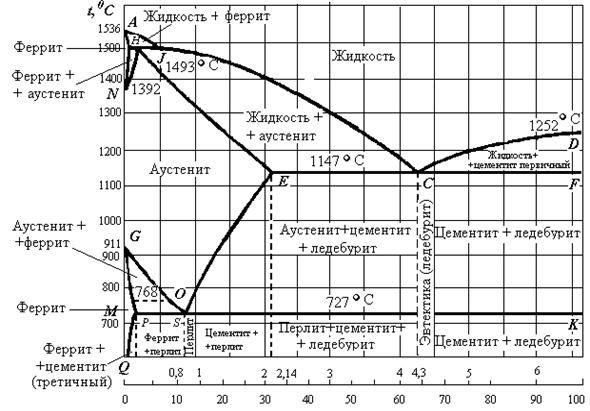
Ионные К. щелочных металлов разлагаются при т-ре ок. 800 °С, К. щел.-зем. металлов в интервале 1800-2300°С, ковалентные К. и металлоподобные разлагаются и плавятся при более высоких т-рах. В периодич. системе в пределах группы т-ры плавления К. возрастают с увеличением порядкового номера металла и обычно в 1,5-2 раза выше, чем т-ры плавления соответствующих металлов. Это обусловлено высокой прочностью связи М-С.
Металлоподобные К. обладают металлич. проводимостью, для них характерен положит. температурный коэф. r. Для сесквикарбидов величина r (достигает 500 мкОм. см) примерно на порядок выше, чем для дикарбидов и монокарбидов (20-50 мкОм. см). Дикарбиды РЗЭ также обладают металлич. св-вами. Карбиды В и Si, а также Be, Mg и Аl — полупроводники.
Мех. св-ва К. зависят от прочности хим. связи, степени ее ковалентности и межатомного расстояния. наиб. высокой твердостью обладают карбиды В, Si, Be, а также монокарбиды РЗЭ и переходных металлов; твердость последних уменьшается при переходе от К. подгруппы IVа к К. подгруппы VIa. Все К. при комнатной т-ре — хрупкие в-ва, их пластич. деформация возможна в условиях всестороннего сжатия при очень высоких напряжениях. Ионные К. разлагаются водой с образованием метана, ацетилена, метилацетилена или смеси углеводородов и гидроксида металла, напр.:
Аl4 С 3 + 12Н 2 О : 4Аl(ОН)3 + 3СН 4;
Na2C2 + 2Н 2 О : 2NaOH +С 2 Н 2;
Mg2C3 + 4Н 2 О : 2Mg(OH)2 + С 3 Н 4.
Ковалентные и металлоподобные К. не разлагаются водой и большинством минер. к-т и щелочей. Получают К. из элементов, восстановлением оксидов металлов, газофазным способом, металлотермически. Синтез из элементов осуществляют при высоких т-рах в вакууме или инертной атмосфере. В зависимости от технол. параметров процесса образуются порошки с размером частиц от 0,5 мкм до 2 мм. Синтез может осуществляться в режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла, либо в плазме при 5000-10000 К в дуговых, высокочастотных и сверхчастотных плазмотронах.
В результате быстрого охлаждения из парогазовой смеси элементов в плазмообразующем газе (Аr или Не) образуются ультрадисперсные порошки с размерами частиц 10-100 нм. Восстановлением оксидов металлов производят наиб. важные соед . — бора карбиды, кремния карбиды, а также вольфрама карбиды, титана карбид и др. К. переходных металлов.
Газофазным способом получают К. из хим. соед., к-рые испаряются, разлагаются, а затем восстанавливаются и взаимод. друг с другом, напр.:
2МСl + 2ССl4 + 5Н 2 : 2МС + 10НСl.
Чаще всего этот синтез осуществляют в плазме, получая дисперсные порошки. По металлотермич. способу оксиды металлов восстанавливают металлами (Mg, Al или Са) в присут. углерода, напр.:
МО + С + Мg : МС + МgО.
Особо чистые К., не содержащие кислорода и азота, синтезируют взаимод. С и металла в расплаве др. металла или сплава, напр. TiC получают в сплаве Fe Ni. Из ионных К. наиб. важен кальция карбид СаС 2, из ковалентных В 4 С и SiC. Металлоподобные К. упрочняют чугун и сталь [Fe3C, (Fe,Cr)3C, Fe2W2C, (Fe,Cr,Mo)23C6], они являются основой твердых вольфрама сплавов(WC, TiC, WC, TiC, TaC, WC) и др. твердых сплавов (TiC, VC, Сr3 С 2, ТаС), используемых для обработки металлов резанием.
К. применяют также как восстановители, раскислители и катализаторы, они входят в состав жаропрочных и жаростойких композиционных материалов, в т. ч. керметов.
Лит.:
- Стормс Э., Тугоплавкие карбиды, пер. с англ., М., 1970;
- Гольдшмидт X., Сплавы внедрения, пер. с англ., в. 1-2, М, 1971,
- Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М, 1974.
- Самсонов Г. В., Упадхая Г. Ш., Нешпор В. С., Физическое материаловедение карбидов, К., 1974,
- Высокотемпературные карбиды, под ред. Г. В. Самсонова, К, 1975,
- Карбиды и сплавы на их основе, под ред. Г. В. Самсонова, К, 1976,
- Свойства, получение и применение тугоплавких соединений, Справочник, под ред. Т. Я. Косолаповой. М, 1986, П. С. Кислый.
- Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
Источник:
- Что такое карбид. Свойства карбида. Применение карбида
- Что такое карбид
- Виды карбидов
- Применение карбида
- Получение карбидов
- Цена карбида
- Большая Энциклопедия Нефти и Газа
- Карбид кальция для сварки — как используется?
- Как используют карбид кальция?
- Техника безопасности при использовании карбида кальция
- Карбид для газовой сварки
- Производство карбида
- Процесс получения ацетилена из карбида
- Что это такое — карбид
- Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно)
- При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки
- Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении
- Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен
- Карбид кремния – перспективный материал силовой электроники: свойства и характеристики
Что такое карбид. Свойства карбида. Применение карбида

Что такое карбид? Попробуем ответить на вопрос, кажущийся неважным в детстве.
Что такое карбид
Карбит – не конкретное вещество, а группа соединений элементов с углеродом. Последний должен быть более электроотрицательным, чем «сосед».
Это обязательное условие, исключающее из ряда карбидов галогениды и оксиды углерода.
Под электроотрицательностью понимается способность атома сдвигать к себе электроны других веществ.
Электротрицательность углерода равна 2,6. Это данные шкалы Полинга. Она выстроена с учетом, что ионность в ковалентной связи делает эту связь прочнее.
Получается, электротрицательность вторых элементов в карбидах должна быть меньше 2,6.
Большинство подходящих элементов – металлы. Но, около 15% карбидов их не содержат.
Внешне карбиды – кристаллические, как правило, бесцветные, прозрачные вещества. Блеск у них алмазный.
Им соединения обязаны углероду, который является основой не только карбидов, но и алмазов.
По сути, герои статьи являются бриллиантами, в которых часть атомов замещена другими элементами.
Есть и цветные дуэты с углеродом, к примеру, карбид железа. Это всем знакомый цемент. Окрас у соединения серый.
Получается, свойства карбидов могут разниться. Несовпадения рассмотрим в главе «Виды». Пока же, изучим общие характеристики класса соединений.
Свойства карбида
К общим свойствам карбидов относится твердость. Она может быть больше, или меньше, но всегда выше среднего.
У некоторых представителей группы показатель близок к корунду и алмазу. Это самые твердые минералы на земле.
Особенно отличились карбиды переходных металлов. Это элементы побочных подгрупп периодической системы. У всех переходных металлов есть электроны на d- и f-орбиталях.
Обобщает карбиды и высокая температура плавления. Как правило, она выше, чем у входящего в соединение металла. Если он из переходных, размягчение может начинаться лишь при 3000 градусов Цельсия.
Интересно, что температура плавления поднимается вместе с номером группы, к коей принадлежит «сосед» углерода.
Наиболее тугоплавкими являются карбиды с элементами из 5-7-ой групп таблицы Менделеева. Где карбид можно понять по структуре соединений. Их решетки, зачастую, дефектны.
Это значит, есть отклонения от теоретической схемы, разрывы и смещения. Именно поэтому свойства карбидов могут в 100, а то и 1000 раз разниться с высчитанными по формулам. Так, многие соединения класса устойчивы к коррозии и не растворяются в большинстве кислот.
Виды карбидов
Основных видов карбидов три. Первый – ковалентные соединения. Валентность – предрасположенность к определенному числу химических связей.
Ковалентная связь – это перекрытие валентных облаков разных элементов. То есть, у них образуются общие электронные пары. Именно такие лежат в основе ковалентных карбидов.
К ковалентным относятся карбиды лишь двух элементов: брома и кремния. Оба соединения химически инертны. Их межатомные связи прочны.
В итоге, карбиды группы трудно расплавить, — решетка не хочет рушиться. Прочность связи делает оба соединения твердыми.
Карбид брома даже соперничает с алмазом. Некоторые образцы углеродного соединения царапают бриллианты, то есть, тверже них.
Карбид кремния алмаз не «побеждает», но свои достойные 8 баллов по шкале Мооса имеет.
Растворяют ковалентные карбиды лишь плавиковая кислота, концентрированная азотная и царская водка. Окисление карбидов группы происходит лишь при нагреве до 1000 градусов.
Второй вид карбидов – ионный. Его, так же, именуют солеобразным. Все образованны металлами 1-ой и 2-ой групп таблицы Менделеева.
В класс включен и карбид алюминия. Соединения группы разлагаются не только кислотами, но и водой.
Камешки, заставляющие «закипать» лужи, к примеру, — карбид кальция. Он, кстати, довольно токсичен, может разъесть слизистые. Зачем же его завозят на строительные рынки, поймем в следующей главе.
При реакции ионных карбидов с водой выделяется водород. В жидкости формируется и выпадает в осадок гидроксид металла.
Реакция протекает бурно. Резкий выброс на поверхность воды водорода и дает то самое пузырение.
Третий вид карбидов – ионно-ковалентно-металлические, попросту, металлоподобные.
Такие соединения формируются элементами 4-ой, 5-ой, 6-ой, 7-ой групп периодической системы. Исключения: — карбиды никеля, кобальта и железа.
Если у ковалентных карбидов химическая активность низкая, а у ионных – высокая, то у третьего вида соединений она средняя.
Примечательно строение молекул. Их основа – атомы металла. Атомы же углерода находятся в пустотах между ними.
Поэтому, к примеру, карбид вольфрама называют внедренным. Имеется в виду, что углерод внедрился в кристаллическую решетку металла.
Такое строение обеспечивает рекордную прочность и высокую температуру плавления. Еще одно известное соединение группы – карбид титана.
Применение карбида
Карбид титана стал основой безвольфрамовых, но столь же твердых сплавов.
К тому же, соединение служит покрытием инструментария, в основном, промышленного и строительного.
Такое напыление сводит к минимуму износ деталей и позволяет обрабатывать ими даже самые твердые материалы.
Карбид кремния, так же, используют в качестве абразива. В природном виде, коим является минерал муассанит, соединение цениться ювелирами, причем, выше чем близкий по виду и свойствам фианит.
Карбид кальция нужен при сварочных работах. Из соединения получают ацетилен. Карбид служит его источником, а заодно, и топливом для машин кислородной сварки.
Ацетилен – газ. Одного его достаточно для работы аппаратов. Но, есть еще и вода. Карбид кальция вступает с ней в бурную реакцию.
Итог – не только пузырьки, нравящиеся детям, но и обилие тепла – еще одного источника энергии.
Карбид бора применяют в качестве огнеупора. Температура плавления соединения составляет почти 2500 градусов.
Прочность карбида позволяет добавлять его в бронежилеты. Защитить материал способен не только от пуль, но и радиации.
Поэтому, один из ответов на вопрос, где взять карбид бора, — в защитных экранах, задерживающих излучение.
Список карбидов и их роли в жизни общества может занять многие страницы. Соединений несколько десятков и у каждого из них есть применение, причем, не одно. Нет и единственной схемы получения карбидов.
Придется ограничиться общими фразами. Однако, и в них есть толика полезной информации.
Получение карбидов
Большинство карбидов именно получают, а не добывают. Первый синтез проведен в начале 19-го столетия.
Англичанин по фамилии Дэви получил карбид калия. В 1863-ем создали карбид меди.
Он оказался неустойчивым, в отличие от третьего синтезированного соединения углерода с железом.
Смотря на опытные образцы, ученые не могли понять, где найти карбид за пределами лабораторий.
Минералы, в которых металлы соединены с углеродом открыли лишь в начале 20-го века.
Кроме муассанита, геологи нашли когенит – смесь карбида кобальта с никелем и железом.
Судя по дате открытия карбидных минералов, они не являются распространенными.
Поэтому, в промышленных масштабах героев статьи до сих пор синтезируют. Масса карбида может получиться, к примеру, из древесного угля и оксидов металлов.
Они преобразуются в карбиды при помощи вольтовой дуги и электрической печи.
Цена карбида
Карбид кальция купить предлагают примерно за 40-90 рублей за килограмм. Соединение углерода с бором стоит от 100-та рублей за кило.
Купить карбид кремния предлагают примерно по 160 рублей за 1000 граммов.
А вот за кило карбида гафния придется выложить около 21 000 рублей, причем, при оптовых закупках.
То есть, стоимость материала во многом зависит от присутствующего в нем металла, или неметалла. Существует даже карбид золота.
Он, кстати, способен взорваться при простом пересыпании порошка. Так что, даже за большую цену, доставить сырье потребителю – задача не из легких.
Источник:
Большая Энциклопедия Нефти и Газа

Применение карбидов и нитридов основано на свойствах этих веществ, позволяющих использовать их в экстремальных условиях. Особый интерес представляют карбиды и нитриды переходных металлов, 4 / — и 5 / — элементов.
Большинство карбидов и нитридов по электрическим и магнитным свойствам сходны с соответствующими металлами. Некоторые нитриды ( например, NbN), карбиды NbC, Nb2C, WC и другие обладают свойствами сверхпроводимости при очень низких температурах.
Существенным недостатком нитридов и карбидов, ограничивающим области их применения, является хрупкость. [1]
Применение карбидов весьма разнообразно. Они используются в качестве абразивных материалов ( В4С), огнеупоров ( В4С, ТаС), полупроводниковых материалов ( В4С), поглотителей нейтронов в ядерных реакторах ( В4С), металлокерамических твердых сплавов ( W2C, TiC, TaG), как легирующие добавки при получении жаропрочной стали. Карбид кальция применяется для получения ацетилена. [2]
Дляприменения карбида вольфрама в качестве материала для режущих инструментов порошок карбида вольфрама прессуют и спекают при температуре 1400 С с порошком кобальта; при этом кобальт служит пластичной связкой для карбида вольфрама. Высокие твердость [ HRA 85 — 90 ( HRC 66 — 76) 1 и красностойкость ( до 900 — 1000 С) этих сплавов позволили значительно увеличить скорость резания. [3]
Расширенное производство и применение карбида титана привело его из объектов, удобных и интересных для исследований в области физики твердого тела, в объект широкого промышленного использования. В последние годы в отечественных и зарубежных журналах ежемесячно появляются десятки статей, посвященные получению и применению карбида титана. [4]
За последние 10 лет применение цементированного карбида вольфрама приобретает все большее значение. [5]
Все отмеченное следует учитывать и в случае применения карбида. [7]
Ввиду дефицитности вольфрама ведутся интенсивные исследования по применению карбидов менее дефицитных металлов и других тугоплавких соединений высокой износостойкости. [8]
Гораздо менее универсальны методы, основанные на применении карбидов или гидратов металлов. [9]
Приведены сведения о методах получения, свойствах, областях применения карбида титана. Даны характеристики процессов н описана аппаратура для покрытий из карбида титана. Описаны свойства твердых сплавов на основе карбида титана. Обсуждена эффективность применения карбида титана в различных отраслях техники. [10]
Для обеспечения износостойкости конструкции клапан и седло изготовлены с применением карбида вольфрама, а цанговый элемент выполнен из пружинной стали. [11]
Приведенный обзор сведений о строении, свойствах, технологии и применении карбидов вольфрама как в поликристаллическом, так и в монокристаллическом состояниях отражает не только своеобразные свойства этих тугоплавких веществ и возможности их технического использования, но и еще скрытые возможности изучения карбидных фаз вольфрама. [12]
В обзорной статье Бижона 1175 описываются основные методы получения, физико-химические свойства и области применения карбидов, нитридов и силицидов молибдена. [13]
В монографии обобщен фактический материал по диаграмме состояния, кристаллической структуре, свойствам и применению карбида вольфрама, имеющего большое значение в технике.
Подробно описаны методы получения, термодинамические, химические, физико-механические свойства карбидов вольфрама и сложных карбидных систем с его участием.
Изложены современные представления о природе межатомной связи, рассмотрена технология изготовления изделий из карбида вольфрама. [14]
Эти исследователи приводят данные по синтезу аммиака при температуре 515Ь и давлении 114 am, при применении карбида урана в качестве катализатора. [15]
Источник:
Карбид кальция для сварки — как используется?
Карбид для сварки – вначале 80-х даже маленький кусочек этого вещества был настоящим сокровищем. Его обладатель поднимал свой «дворовой» статус до высоты ближайшей многоэтажки. Но наше поколение выросло и посмотрело на многие вещи под другим углом. В том числе и на карбид кальция. И сейчас это уже не сокровище, а источник ацетилена для газосварочного аппарата.
Как используют карбид кальция?
Рецепт карбидной бомбы мы приводить не будем. Нас интересует «гражданское» использование этого материала в формате «карбид-сварка». Эта схема употребления карбида предполагает контролируемое замачивание данного вещества в герметичной емкости, с последующим сбором продукта гидратации – горючего газа ацетилена.
Сам процесс использования карбида кальция выглядит следующим образом:
- Куски карбида загружают в корзину. Причем оптимальный размер кусков – 8 сантиметров в диаметре. Такие «камни» обеспечат оптимальный режим генерацию ацетилена. А вот карбидную пыль в генераторе использовать нельзя – камешки диаметром менее 2 миллиметров выделяют газ практически мгновенно, что приводит к риску взрывной разгерметизации устройства.
- Корзину помещают в аппарат, предварительно заполненный водой, горловину которого закрывают крышкой-траверсой с винтом поперечной подачи.
- Вращая маховик винта, вы погружаете корзину с карбидом в воду и даете старт процессу генерации ацетилена. Причем крупнокусковой карбид кальция — для сварки, напомним еще раз, нужен именно такой тип вещества — начинает «таять» постепенно и, увеличивая или уменьшая глубину погружения, можно управлять интенсивностью генерации горючего газа, поддерживая нужный уровень давления в горелке сварочного аппарата.
Ведь заполненную горючим веществом емкость под давлением (баллон) очень сложно транспортировать. А кусковой карбид достаточно сложить в железную банку, закрыть герметичной крышкой и перевозить на любые расстояния, поддерживая нулевую влажность материала.
Собственно, безопасность транспортировки и низкая цена карбида для сварки, килограмм которого выделяет до 250 литров ацетилена, поддерживают данную архаичную технологию стыковки металла даже в наше время высоких технологий. Согласитесь: мобильный сварочный аппарат или резак, функционирующий практически на твердом топливе, выглядит более чем привлекательно. Тем более, что в «разобранном» виде генератор абсолютно безопасен.
Впрочем, работа с карбидом требует соблюдения некоторых правил безопасности. Ведь этот материал относится к достаточно опасным веществам.
Техника безопасности при использовании карбида кальция
На «заряженные» ацетиленовые генераторы распространяются те же правила, что действуют и в случае работы с прочими взрывоопасными баллонами. То есть, генератор ацетилена следует держать в вертикальном положении, используя только в случае отсутствия видимых повреждений корпуса (вмятин, трещин и так далее).
Кроме того, ацетиленовые генераторы нельзя использовать в подвалах или плохо проверчиваемых помещениях. Ведь этот горючий газ может взорваться от малейшей искры. Поэтому карбид кальция нужно оградить от контакта даже с атмосферной влагой.
И, да, возле генератора ацетилена категорически запрещается: курить, использовать для резки заготовок болгарку, включать электродуговой сварочный аппарат, разводить костры или просто поджигать горелку этого же аппарата. Отойдите от места сварки, как минимум на 10 метров.
Кстати, минимальная длина шланга от генератора до горелки равна именно 10 метрам.
Источник:
Карбид для газовой сварки
Газовая сварка выполняется посредством использования горючих газов, главное место среди которых занимает ацетилен. Газ, смешиваясь с кислородом, выдает наивысшую температуру сварочного пламени — до 3200 градусов.
Его получают в заводских условиях и, упакованным в специальные баллоны, доставляют к месту проведения сварочных работ. Другой способ добычи ацетилена – использовать генератор, который производит газ непосредственно там, где нужна сварка.
Главный компонент для работы генератора — это карбид.
Материал представляет собой вещество темно-серого или коричневатого оттенка с химической формулой СаС2. Взаимодействуя с водой он делится на ацетилен и гашеную известь. По теоретическим расчетам из одного килограмма чистого карбида кальция можно добыть 370 дм³ газа, но в реальности сказывается присутствие примесей, и результат получается несколько иной – всего около 280 дм³.
Кроме того, фактический выход ацетилена зависит от размера кусков карбида, его однородности. На продолжительность реакции влияет степень грануляции карбида и температура распада. Процесс гидролиза карбида кальция выглядит следующим образом: СаС2 + Н2О = С2Н2 + Са(ОН). Фактическая потребность в воде на 1 кг сухого вещества колеблется в пределах от 5 до 20дм³.
Производство карбида
Что такое карбид кальция? Это продукт, получаемый в результате термической реакции окиси кальция и кокса.
Основным сырьем для его производства служат известняки, к которым предъявляются особые требования.
Сырье должно быть однородным, поэтому карбидные предприятия обычно работают на известняках из хорошо изученных месторождений. Технологический процесс складывается из нескольких этапов:
- обжиг известняка в специальных печах;
- приготовление шихты;
- получение карбидного сплава;
- дробление и разделение на фракции конечного продукта.
Сам материал и его производство относится к разряду взрыво- и огнеопасных. Поэтому государственными нормативами предусмотрено строжайшее выполнение правил безопасного хранения и обращения с карбидом кальция. Основные требования таковы:
- карбид кальция поступает в продажу упакованным в стальные герметично закрытые барабаны или контейнеры;
- помещение для хранения строится из негорючих материалов; должно быть сухим, закрытым, исключающим попадание влаги, иметь возможность проветривания;
- в хранилище не допускается наличие водопровода, канализации, водяного отопления;
- уровень поверхности пола необходимо делать выше нулевой отметки не менее, чем на 20 см;
- вскрывать барабан разрешается только ручным способом (молоток, зубило) или специальным режущим инструментом (не электрическим);
- единовременно открытым может быть только один барабан;
- в случае неполного использования емкость закрывают временной водонепроницаемой крышкой;
- обязательное наличие средств противопожарной защиты и малой механизации для перемещения продукта.
Емкости с карбидом кальция можно складировать и в горизонтальном, и в вертикальном положении. Свободную тару необходимо хранить в специально отведенных местах.
Процесс получения ацетилена из карбида
Устройство для получения ацетилена из карбида кальция называется ацетиленовый генератор. Оборудование бывает передвижным и стационарным. Мобильные генераторы используются, в основном, при проведении ремонтных работ, стационарные – на объектах с большими объемами сварочных процессов. Как получают ацетилен из карбида кальция? Принцип работы генератора состоит в следующем:
- Камера, предназначенная для газообразования, заполняется водой в расчетном объеме.
- Необходимое количество карбида кальция загружается в газообразующую камеру через специальный бункер. Запрещается использовать карбидную пыль, поскольку она может привести к мгновенному выделению газа и разгерметизации аппарата.
- Подача карбида для сварки из бункера в камеру происходит порциями в автоматическом режиме.
- По мере подачи каждой порции давление внутри камеры возрастает. Его снижение служит командой для загрузки последующей части карбида.
- В процессе взаимодействия карбида кальция с водой и происходит выделение ацетилена, который через отборник подается в шланг, ведущий к сварочной горелке.
Вторичный продукт в виде гашеной извести удаляется из генератора при помощи специального бункера. При работе с ацетиленовым генератором надо помнить, что в непосредственной близости от него категорически нельзя курить и пользоваться электрическими инструментами. Газовая горелка должна находиться не ближе 10 метров. Именно такого размера должна быть минимальная длина сварочного шланга.
Если возникла потребность в сварочных работах и нужно решить, где взять карбид, то надежнее всего обратиться к прямым поставщикам или купить в интернет магазинах, которые организуют доставку транспортной компанией.
Источник:
Что это такое — карбид
 КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Карбиды, как оказалось, можно получить не только в лаборатории. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Карбиды, как оказалось, можно получить не только в лаборатории. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
Карбиды — тугоплавкие твёрдые вещества. Они нелетучи и не растворимы ни в одном из известных растворителей. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. К первой группе относятся так называемые солеобразные карбиды с ионной связью.
Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно)
При этом образуются различные углеводороды и гидроксид металла. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке).
Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Карбид, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах. Эти соединения обладают удивительным разнообразием физических и химических свойств.
Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C.
При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки
Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства.
Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды.
Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами.
Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов.
Распространение Натрия в природе. Химические свойства Натрия. При непосредственном взаимодействии с кислородом в зависимости от условий образуется оксид Na2O или пероксид Na2O2 — бесцветные кристаллические вещества.
С водой Натрий образует гидрооксид NaOH и H2; реакция может сопровождаться взрывом.
Минеральные кислоты образуют с Натрием соответствующие растворимые в воде соли, однако по отношению к 98-100%-ной серной кислоте Натрий сравнительно инертен.
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении
Натрий растворяется в жидком аммиаке (34,6 г на 100 г NH3 при 0°C) с образованием аммиачных комплексов. Натрий входит в состав многих практически важных сплавов. В сплаве на основе свинца (0,73% Ca, 0,58% Na и 0,04% Li), применяемом для изготовления осевых подшипников железнодорожных вагонов, Натрий является упрочняющей добавкой.
Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен
Натрий в организме. Натрий — один из основные элементов, участвующих в минеральном обмене животных и человека. Содержание Натрия в тканях растений относительно высокое (около 0,01% на сырую массу). Прильем из капельной воронки раствор хлорида натрия в колбу с карбидом кальция.
Химическая номенклатура – свод правил, позволяющих однозначно составить ту, или иную формулу или название любого химического вещества, зная его состав и строение. Получают карбонат натрия по довольно сложной технологии из хлорида натрия, а используют, в основном, в производстве стекла.
О3 малоустойчив и даже при комнатной температуре медленно превращается в кислород. Очень реакционноспособен, разрушает органические вещества, реагирует со многими металлами, в том числе с золотом и платиной.
Карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью. 4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС=С–СН3. 2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах.
Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного.
Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы.
Природные соединения Натрия — поваренная соль NaCl, сода Na2CO3 — известны с глубокой древности. Название «Натрий», происходящее от арабского натрун, греч. nitron, первоначально относилось к природной соде.
Уже в 18 веке химики знали много других соединений Натрия.
По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ.
Источник:
Карбид кремния – перспективный материал силовой электроники: свойства и характеристики
Силовая электроника — это важная часть электроэнергетики в целом. В связи со значительным развитием электронной и микроэлектронной промышленности потребность в новых материалах резко возрастает. Особое значение имеет надежность изделий электронной техники и их стойкость к различным воздействиям окружающей среды.
Известно, что эффективность устройств электроники, особенно работающих в экстремальных условиях (высокие температуры, агрессивные среды, радиация), существенно зависит от повышения быстродействия, энергосбережения и надежности элементной базы, в том числе и от способности ее работы. Одним из материалов, на основе которого можно выпускать электронные приборы, соответствующие столь жестким требованиям, является карбид кремния (SiC).
В последнее десятилетие наметился существенный прогресс, как в технологии полупроводникового карбида кремния, так и технологии приборов на его основе. Происходит быстрая модернизация технологии выращивания монокристаллов, увеличение их размеров и улучшение их параметров.
Карбид кремния обладает химической стабильностью, высокой стойкостью к повышенным температурам и радиационным излучением, возможностью легирования его акцепторными и донорными примесями. Все это вызывает интерес к карбиду кремния со стороны разработчиков элементной базы электроники в ряде ведущих стран мира.
В [1] представлены страны, в которых выполняется основной объем работ, а так же компании, ведущие исследования и разработки в области материаловедения SiC и приборов на его основе.
Наиболее успешной в развитии карбидокремниевой индустрии считается компания Cree (США). Достижения компании:
- Силовая электроника — транзисторы Cree с напряжением пробоя более 13кВ SiC силовые модули, способные коммутировать токи до 600А;
- СВЧ-техника — полевые транзисторы на подложках фирмы Cree, с максимальной частотой до 40 ГГц и пробивным напряжением 120В;
- Сенсоры — высокотемпературные (до 600°С), радиационностойкие;
- Полупроводниковые преобразователи температуры, давления (до 1600кПа), потока вибрации, в том числе и для экстремальных условий эксплуатации.
В России наибольшие успехи в технологии карбида кремния и приборов на его основе в последние годы принадлежат ученым и инженерам ФТИ им. А. Ф. Иоффе РАН и Санкт-Петербургского Государственного Электротехнического университета «ЛЭТИ» (бывш. ЛЭТИ им. В. И. Ульянова-Ленина).
Уникальные свойства SiC все шире используются для производства полупроводниковых приборов для электроники, микроэлектроники и оптоэлектроники.
Карбид кремния — это слоистый материал, свойства которого зависят от порядка чередования наноразмерных элементов (слоев).
Фактически, SiC имеет слоистую структуру, построенную из элементарных слоев трех типов A, B и C, которые отличаются друг от друга кристаллической упаковкой в пределах одного слоя.
Период повторения их последовательности может варьироваться от десятков ангстрем до десятка нанометров, что обеспечивает формирование слоистых решеток, макроскопические свойства которых зависят от взаимного расположения таких слоев.
В результате при синтезе формируется ряд индивидуальных слоистых модификаций, которые называются политипами и отличаются электрофизическими (ширина запрещенной зоны, подвижность носителей заряда), оптическими (коэффициенты поглощения, преломления) и химическими (скорость окисления, диффузии примесей) свойствами.
Политипы на основе плотноупакованного слоя могут иметь кубическую (С), гексагональную (Н), ромбоэдрическую (R), и тригональную (Т) решетки. Трехслойный политип, например, с кубической решеткой обозначается как 3С, а шестислойный гексагональный политип — 6Н. На рис. 1 показано структурное упорядочение семейства естественных сверхрешеток карбида кремния:
- вид упаковок А, В, С в пределах слоя,
- элементарные ячейки основных слоистых модификаций.
Также на основе карбида кремния возможно формирование объектов, которые представляют собой гетероструктуры в виде сочетания различных модификаций SiC: кубической и гексагональной 3C-2H и 3C-6H.
В таблице 1 приводится сравнение основных электронных свойств карбида кремния политипа 4H(4H-SiC) с кремниевыми (Si) и арсенидгалиевыми (GaAs) полупроводниковыми приборами.
Таблица 1
| Наименование | Si | GaAs | 4H-SiC |
| Ширина запрещенной энергетической зоны, эВ | 1,12 | 1,5 | 3,26 |
| Подвижность электронов, см2/с∙В | 1400 | 9200 | 800 |
| Подвижность дырок, см2/с∙В | 450 | 400 | 140 |
| Концентрация собственных носителей, см-3 при 300∙К | 1,5х1010 | 2,1х106 | 5х10–9 |
| Скорость объемного заряда электронов, см/с∙107 | 1,0 | 1,0 | 2,0 |
| Критическая напряженность электрического поля, МВ/см | 0,25 | 0,3 | 2,2 |
| Теплопроводность, Вт/см∙К | 1,5 | 0,5 | 3,0–3,8 |
| Температура Дебая, К | 640 | 550 | 1430 |
Можно выделить следующие преимущества материалов SiC по сравнению с Si и GaAs:
- Напряженность электрического поля пробоя 4H-SiC более чем на порядок превышает соответствующие показатели у Si и GaAs. Это приводит к тому, что значительно снижается сопротивление в открытом состоянии. На рис. 2 показана зависимостьот напряжения пробоя кристалла. Можно видеть, что при напряжении 600 В SiC-диод имеетGaAs-диод —, Si-диод —. Малое удельное сопротивление в открытом состоянии в сочетании с высокой плотностью тока и теплопроводностью позволяет использовать очень малые по размерам кристаллы для силовых приборов.
- Большая ширина запрещенной энергетической зоны является результатом более высокого барьера Шоттки по сравнению с Si и GaAs. В результате чрезвычайно малый ток утечки (менее 700мкА при 200°С) при повышенной температуре кристалла снижает термоэлектронную эмиссию за пределами барьера.
- Высокая теплопроводность SiC снижает тепловое сопротивление кристалла (по сравнению с Si-диодами — почти в два раза).
- Электронные свойства приборов на основе карбида кремния очень стабильны во времени и слабо зависят от температуры, что обеспечивает высокую надежность изделий.
- Карбид кремния чрезвычайно устойчив к жесткой радиацией, воздействие которой не приводит к деградации электронных свойств кристалла.
- Высокая рабочая температура кристалла (более 600°С) позволяет создавать высоконадежные приборы для жестких условий эксплуатации и специальных применений.
- Карбид кремния выделяет высокая температура Дебая, которая характеризует его устойчивость к внешним воздействиям.
Литература:
- Карбид кремния: технология, свойства, применение / Агеев О А., Беляев А. Е., Болтовец Н. С., Киселев B. C., Конакова Р. В., Лебедев А. А., Миленин В. В., Охрименко О. Б., Поляков В. В., Светличный A. M., Чередниченко Д. И. / Под общей редакцией член-корр. НАНУ, д.ф.-м.н., проф. Беляева А. Е. и д. т.н., проф. Конаковой Р. В. — Харьков: «ИСМА». 2010. — 532 с.
- Лучинин В., Таиров Ю. Карбид кремния — алмазоподобный материал с управляемыми наноструктурно-зависимыми свойствами // Наноиндустрия. — 2010, № 1. с. 36–40.
- Полищук А. Полупроводниковые приборы на основе карбида кремния — настоящее и будущее силовой электроники // Компоненты и технологии. — 2004. № 8.
Источник: