29.04.2018
В таблице приводятся температуры кипения и плавления простых веществ (химических элементов). Цифры в скобках обозначают, что вещество при данной температуре и разлагается.
Температура кипения и плавления простых веществ
Сокращения: г.— газ; ж. — жидкость; тв. — твердое вещество: возг. — возгорается; ромб. — ромбическая.
| Название элемента | Символ | Состояние | Температура плавления | Температура кипения, °С |
| Азот | N | Г. | —209,86 | —195,8 |
| Актиний | Ас | ТВ. | ~1040 | ~3300 |
| Алюминий | Аl | ТВ. | 660,1 | ~2500 |
| Америций | Ат | ТВ. | ~1200 | ~2600 |
| Аргон | Аr | Г. | —189,2 | —185,7 |
| Астат | At | 334 | ||
| Барий | Ва | ТВ. | 710 | 1640 |
| Бериллий | Be | ТВ. | 1285 | 2970 |
| Бор | В | ТВ. | ~2075 | ~3800 |
| Бром | Вr | Ж. | —7,3 | 58,8 |
| Ванадий | V | ТВ. | 1900 | 3400 |
| Висмут | Bi | ТВ. | 271,3 | ~1560 |
| Водород | Н | Г. | —259,18 | —252,8 |
| Вольфрам | W | ТВ. | 3380 | 5900 |
| Гадолиний | Gd | ТВ. | 1312 | ~1500 |
| Галлий | Ga | Ж. | 29,8 | ~2230 |
| Гафний | Hf | ТВ. | ~2230 | ~5400 |
| Гелий | Не | Г. | —272,2 | —268,9 |
| Германий | Ge | ТВ. | 936 | 2700 |
| Гольмий | Но | ТВ. | 1500 | ~2380 |
| Диспрозий | Dy | ТВ. | 1380 | ~2330 |
| Европий | Eu | ТВ. | ~900 | ~1430 |
| Железо | Fe | ТВ. | ~1535 | ~3000 |
| Золото | Au | ТВ. | 1063 | ~2847 |
| Индий | In | ТВ. | ~155 | ~2000 |
| Йод | J | ТВ. | 114 | 183 |
| Иридий | Ir | ТВ. | 2450 | ~500 |
| Иттербий | Yb | ТВ. | 824 | ~132 |
| Иттрий | Y | ТВ. | ~1500 | 3020 |
| Кадмий | Cd | ТВ. | 321,03 | 7670 |
| Калий | К | ТВ. | 62,3 | ~7605 |
| Кальций | Ca | ТВ. | 850 | 1482 |
| Кислород | О | Г. | —218,4 | —182,97 |
| Озон | Г. | —251 | —112 | |
| Кобальт | Со | ТВ. | ~1490 | ~2900 |
| Кремний | Si | ТВ. | 1420 | ~2600 |
| Криптон | Кr | Г. | —157 | —152,9 |
| Ксенон | Хе | Г. | —112 | —108,1 |
| Кюрий | Сm | ТВ. | … | … |
| Лантан | La | ТВ. | 920 | ~3470 |
| Литий | Li | ТВ. | 186 | ~(1370) |
| Лютенций | Lu | ТВ. | 1675 | ~2680 |
| Магний | Mg | ТВ. | 651 | ~1110 |
| Марганец | Mn | ТВ. | 1260 | ~1900 |
| Медь | Cu | ТВ. | 1083 | ~2300 |
| Молибден | Mo | ТВ. | 2625 | ~3700 |
| Мышьяк | As | ТВ. | 814 (36 бар) | 615, возг. |
| Натрий | Na | ТВ. | 97,5 | ~880 |
| Неодим | Nd | ТВ. | 1024 | 3210 |
| Неон | Ne | Г. | —248,67 | —245.9 |
| Нептуний | Np | ТВ. | 640 | … |
| Никель | Ni | ТВ. | 1453 | 2900 |
| Ниобий | Nb | ТВ. | (2500) | 3700 |
| Олово | Sn | ТВ. | 231,91 | 2270 |
| Осмий | Os | ТВ. | 2700 | >5300 |
| Палладий | Pd | ТВ. | 1552 | >2500 |
| Платина | Pt | ТВ. | 1773,5 | 4300 |
| Плутоний | Pu | ТВ. | 673 | 3230 |
| Полоний | Po | ТВ. | 254 | 952 |
| Празеодим | Pr | ТВ. | 940 | 3017 |
| Прометий | Pm | ТВ. | ~1000 | … |
| Протактиний | Pa | ТВ. | ~1400 | ~4000 |
| Радий | Ra | ТВ. | 960 | 1140 |
| Радон | Rn | Г. | —71 | —61,8 |
| Рений | Re | ТВ. | 3170 | >5440 |
| Родий | Rh | ТВ. | 1966 | >3000 |
| Ртуть | Hg | Ж. | —38,87 | 356,58 |
| Рубидий | Rb | ТВ. | 38,5 | 700 |
| Рутений | Ru | ТВ. | 1950 | (2700) |
| Самарий | Sm | ТВ. | 1072 | 1670 |
| Свинец | Pb | ТВ. | 327,3 | 1740 |
| Селен | Se | ТВ. | 220 | 688 |
| Сера (ромб.) | S | ТВ. | 112,8 | 444,60 |
| Серебро | Ag | ТВ. | 960,8 | ~2160 |
| Скандий | Sc | ТВ. | 1200 | 2400 |
| Стронций | Sr | ТВ. | 725 | 1150 |
| Сурьма | Sb | ТВ. | 630 | 1380 |
| Таллий | TI | ТВ. | 302,5 | 1457 |
| Тантал | Та | ТВ. | 3000 | (4100) |
| Теллур | Те | ТВ. | 452 | 1390 |
| Тербий | Tb | ТВ. | 1368 | 2480 |
| Технеций | Тс | ТВ. | ~2300 | ~4700 |
| Титан | Ti | ТВ. | ~1800 | >3000 |
| Торий | Th | ТВ. | 1845 | >3000 |
| Тулий | Tu | ТВ. | 1600 | 1720 |
| Углерод алмаз | С | ТВ. | >3500 | 4200 |
| Углерод графит | C | ТВ. | 3600 | ~4200 |
| Уран | U | ТВ. | (1150) | ~3900 |
| Фосфор белый | P | ТВ. | 44,1 | 280 |
| фосфор красный | P | ТВ. | 590 (43 бар) | 423, возг. |
| Франций | Fr | ТВ. | 17,5 | … |
| Фтор | F | Г. | —223 | —187 |
| Хлор | Cl | Г. | —102 | —34,1 |
| Хром | Сг | ТВ. | 1615 | 2200 |
| Цезий | Cs | ТВ. | 28,5 | 670 |
| Церий | Се | ТВ. | 804 | ~3000 |
| Цинк | Zn | ТВ. | 419,5 | 907 |
| Цирконий | Zr | ТВ. | ~1900 | ~4000 |
| Эрбий | Ег | ТВ. | 1525 | ~2500 |
Источник:
ПОИСК
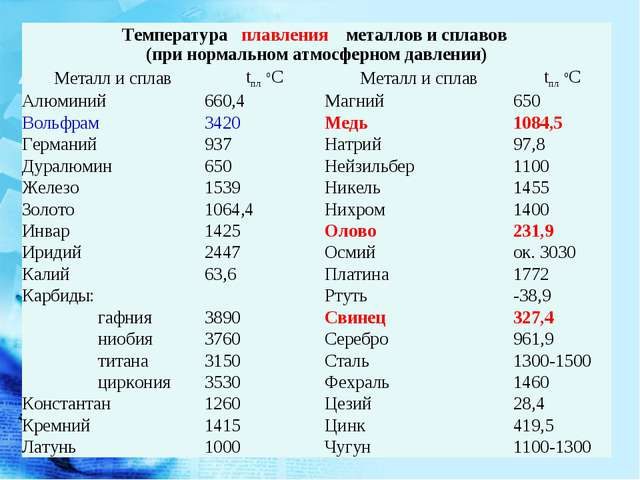 Металлы, температура плавления которых превышает температуру плавления хрома (1890°С), условно относят к тугоплавким.
Металлы, температура плавления которых превышает температуру плавления хрома (1890°С), условно относят к тугоплавким.
Радиусы атомов ниобия и тантала, а также радиусы их ионов (Э «) очень близки из-за лантаноидного сжатия. Это объясняет большое сходство их физико-химических свойств.
В свободном состоянии ванадий, ниобий и тантал весьма стойки к химическим воздействиям и обладают высокими температурами плавления. Эти металлы вместе с хромом, молибденом, вольфрамом, рением, а также рутением, родием, осмием и иридием относятся к тугоплавким металлам. Тугоплавкими условно считают те металлы, температура плавления которых выше, чем хрома (1890°С). Тугоплавкие металлы и их сплавы играют большую роль в современной технике.
В производстве тугоплавких металлов (вольфрам, титан и другие) применяется метод порошковой металлургии, заключающийся в восстановлении металла из окислов в форме порошка. Тугоплавкие сплавы производятся прессованием металлических порошков с последующим спеканием в электрических печах. Температура спекания порошка обычно составляет 2/3 от температуры плавления металла.
Температура плавления смесей порошков также бывает ниже плавления чистых металлов. Таким образом, применяя порошковую металлургию, удается понизить температуру, требуемую для получения тугоплавких сплавов, что и является крупным преимуществом порошкового метода.
Следует обратить внимание на постепенное снижение температур ликвидуса по мере перехода от литиевой системы к натриевой и калиевой. У литиевой системы кривые ликвидуса располагаются выше 1000°, у натриевой они снижаются до 800°, а у калиевой — еще ниже, т. е. с увеличением ионного радиуса катиона щелочного металла температура плавления смесей уменьшается.
Некоторые физические свойства переходных металлов (температуры плавления и кипения, а также твердость) обусловлены числом имеющихся в их атомах неспаренных -электронов. Эти свойства постепенно усиливаются, достигая максимума в группе Мп, а затем с юза уменьшаются с увеличением порядкового номера элементов.
Помимо рассмотренных типов связи, особо выделяют металлическую связь, которая проявляется при взаимодействии атомов элементов, имеющих избыток свободных валентных орбиталей по отношению к числу валентных электронов.
При сближении таких атомов, например в результате конденсации пара, электроны приобретают способность свободно перемеш,аться между ядрами в пространстве именно благодаря относительно высокой концентрации свободных орбиталей.
В результате этого в решетке металлов возникают свободные электроны (электронный газ), которые непрерывно перемещаются между положительными ионами, электростатически их притягивают и обеспечивают стабильность решетки металлов. Таков механизм образования металлической связи у непереходных металлов.
У переходных металлов механизм ее образования несколько усложняется часть валентных электронов оказывается локализованной, осуществляя направленные ковалентные связи между соседними атомами.
Поскольку ковалентная связь более прочная, чем металлическая, у переходных металлов температуры плавления и кипения выше, чем у щелочных и щелочноземельных металлов, а также у переходных металлов с электронными оболочками, близкими к завершению. Это наглядно видно при сопоставлении температур плавления и кипения металлов 6-го периода .
Металлическое олово серебристо-белого цвета, тускнеет на воздухе. Это мягкий легкоплавкий металл (температура плавления 231,9 °С), существующий в двух аллотропных формах а — серое олово, устойчивое ниже 13,2 °С, и р — белое олово, устойчивое выше 13,2 °С. Выше 161 °С и ниже 13,2 °С олово легко рассыпается в порошок.
Сильное различие в температурах плавления н кипения следует объяснить различием прочности химической связи между атомами в металлах. Исследования показали, что в чистом виде металлическая связь характерна лишь для щелочных и щелочноземельных металлов.
Однако у других металлов, и особенно переходных, часть валентных электронов локализована, т. е. осуществляет ковалентные связи между соседними атомами. А поскольку ковалентная связь прочнее металлической, то у переходных металлов температуры плавления и кипения, намного выше, чем у щелочных и щелочноземельных металлов.
Свойства металлов температура плавления, прочность, твердость — зависят главным образом от прочности металлической связи. Она у разных металлов неодинакова, и особенно велика у тяжелых металлов с достраивающимся предпоследним электронным слоем атома, поэтому такие металлы отличаются высокой тугоплавкостью и высокой твердостью.
Свинец — мягкий пластичный синевато-серый металл температура плавления 237,4°С.
Свойства. Галлий, индий и таллий представляют собой мягкие серебристо-белые металлы. Температура плавления этих металлов составляет 29,8 °С (Ga), 156,4°С (In) и 304 °С (Т1). Галлий отличается от других элементов подгруппы низкой температурой плавления.
Кадмий и ртуть — серебристо-белые металлы. В обычных условиях ртуть — жидкость, ее температура плавления равна —38,9 С. Это самый легкоплавкий металл. Температура плавления кадмия 321 С.
Хром — серебристо-серый металл. Температура плавления его составляет 1890°С, плотность 7,19 г/см . Чистый хром достаточно пластичен, а технический — самый твердый из всех металлов.
К тугоплавким металлам относят металлы, температура плавления которых выше температуры плавления железа (1539°С), кроме металлов платиновой и урановой групп и некоторых редкоземельных, которые ш этому признаку (температуре плавления) также можно отнести к тугоплавким.
Висмут относится к металлам. Температура плавления 544,5 К, температура кипения 1833 5 К. Энтальпия плавления ДЯ л = 10,48 кДж/моль. Энтальпия испарения А исп= 179,1 кДж/моль.
Кристаллический порошок белого цвета с желтоватым оттенком, растворимый в воде (4. .. 5 %). Малотоксичен. Относится к летучим ингибиторам атмосферной коррозии металлов. Температура плавления 129. .. 134 °С.
Защищает от атмосферной коррозии серебро, никель, олово, алюминий. Не полностью защищает оксидированный магний, кадмий, цинк, медь, железо.
На упаковочные материалы, деревянную тару, краски, органические покрытия, текстиль, кожу отрицательного действия не оказывает.
С увеличением содержания кислорода в металле температура плавления ниобия снижается, чем в значительной степени объясняется разноречивость данных из различных источников.
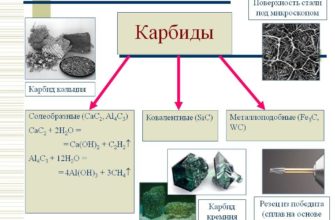
Второе отличительное свойство карбидов и нитридов переходных металлов — очень высокие температуры плавления.
Некоторые карбиды и нитриды плавятся или разлагаются при температурах выше 3000 °С, а ТаС имеет наивысшую из известных температур плавления — примерно 3983 °С (графит возгоняется при 4000°С).
Температуры плавления карбидов обычно выше, чем у соответствующих переходных металлов температуры плавления или разложения нитридов сравнимы с таковыми у чистых переходных металлов.
Сравнивая эти температуры, можно наблюдать интересное смещение номера группы с максимальной температурой плавления. Среди переходных металлов наивысшие точки плавления имеют элементы VI группы среди карбидов — производные элементов V группы.
Висмут — красновато-белый легкоплавкий металл. Температура плавления его 271,3° С.
Свинец принадлежит к числу легкоплавких металлов (температура плавления 327,3° С), характеризуется низкой прочностью и высокой пластичностью. Поэтому свинец редко применяется в качестве конструкционного материала. Чаш,е его используют для футеровки некоторых аппаратов, покрытия жести с целью защиты от радиоактивных излучений, для кабельных изделий и т. д.
Температуры плавления и кристаллизации совпад иот только у гшдивпдуальных веществ, в данном случае только у чистых металлов. Температуры плавления твердого раствора и кристаллизации жидкого раствора одинакового состава различны. Твердый раствор одного состава (например, точка q) находится в равновесии с жидким раствором (расплавом) другого состава (точка г).
Физические свойства. Цинк, кадмий и ртуть являются тяжелыми металлами. Ртуть — единственный жидкий при обыкновенных условиях металл температура плавления его около —39° С. Плотности и атомные объемы возрастают от цинка к ртути, а температуры плавления и кипения в том же направлении падают.
По физическим свойствам эти металлы резко отличаются от щелочноземельных металлов . Теплоты сублимации цинка, кадмия и ртути соответственно равны 131,38 112,97 и, 64,64 кдж1г-атом. Они в 1,3—2,7 раза меньше, чем у кальция, стронция и бария, и этим объясняется большая летучесть этих металлов.
При температурах, близких к абсолютному нулю, цинк (0,84° К) и ртуть (4,12° К) являются сверхпроводниками.
Жидкое состояние вещества является промежуточным между твердым и газообразным. Сбласть существования жидкости ограничена со стороны низких температур переходом в твердое состоянии, а со стороны высоких — переходом в газообразное состояние.
Линия, разделяющая жидкую и газообразную фазы, заканчивается критической точкой, соответствующей температуре и давлению, выше которых невозможно существование жидкости в равновесии с паром. Линия равновесия жидкость — твердая фаза критической точки не имеет.
У металлов температура плавления повышается с увеличением давления у льда, кремния, гер1иа-ния — понижается. Жидкости сочетают некоторые свойства как твердых тел, так и газов.
Твердые тела бывают кристаллические и аморфные. По типам связи кристаллы подразделяют на атомные, ионные, металлические и молекулярные. Они обладают ближним и дальним порядками. Ближний порядок означает правильное расположение около фиксированного атома, иона или молекулы определенного числа ближайших соседей.
Дальним порядком называется расположение частиц в определенной последовательности с образованием единой трехмерной решетки. При наличии дальнего порядка расстояние до любого атома кристалла вычисляется через параметры элементарной ячейки по формуле.
Поскольку ковалентная связь более прочна, чем металлическая, можно ожидать, что у переходных металлов температуры плавления и кипения, а также теплота атомизацпи, выше, чем у металлов.
В электрохимических исследованиях иногда используют электроды из сурьмы. Сурьма — легкоплавкий металл (температура плавления 630,5°С), поэтому ее не/гьзя спаивать со стеклом. Для получения электрода используют одновременное расплавление стеклянной трубки и сурьмы, заключенной в ней, на пламени горелки с последующим вытягиванием трубки в капилляр.
В первый период шихта прогревается и сульфат натрия плавится. Чистый сульфат натрия плавится при 890 °С, но при наличии в шихте примесей сульфида натрия, сульфатов и сульфидов щелочных и п1,елочнозсмельных металлов температура плавления сульфата натрия понижается, В период плавления сульфата натрия скорость., его. восстановления гюстепенно растет.
Искрение зависит от многих факторов, к числу которых относятся температура воспламенения металлов, температура плавления и Кипения металлов и продуктов горения, летучесть веществ и др.
Условно жаропрочными металлами называют металлы, температура плавления которых равна или превышает температуру плавления хрома (1875° С).
Все эти металлы представляют собой элементы переменной валентности, входящие в подгруппы от IV левой до VIII правой периодической системы и включают (в последовательности снижения температуры плавления) вольфрам, рений, осмий, тантал, молибден, иридий, ниобий, рутений, гафний, родий, ванадий и хром.
Вольфрам — самый тугоплавкий металл. Температура плавления его по новейшим данным 3377° С. Температура кипения около 5800° К [121, 122].
Источник:
Температура плавления и кипения различных веществ
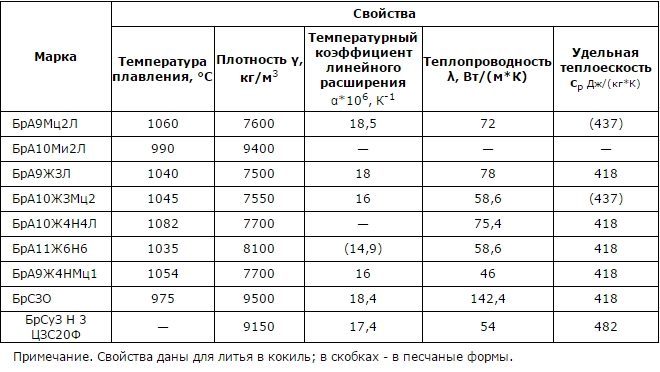
| Вещество | Температуры плавления и кипения, °С |
| Ag | пл. 962, кип. 2170 |
| Ag2O | разл. > 160 |
| Al | пл. 660, кип. 2500 |
| Al2O3 | пл. 2053, кип. > 3000 |
| As | возг. 615, пл. 817 |
| AsH3 | пл.- 117, кип.- 62 |
| At | пл. 244, кип. 309 |
| Au | пл. 1064, кип. 2947 |
| B | пл. 2075, кип. 3700 |
| B2O3 | пл. 450, кип. ок. 2000 |
| Ba | пл. 727, кип. ок. 1860 |
| BaO | пл. ок. 2020 |
| Be | пл. 1287, кип. 2507 |
| BeO | пл. 2580, кип. 4260 |
| Bi | пл. 271, кип. 1564 |
| Bi2O3 | пл. 825, кип. 1890 |
| C (графит) | пл. 4800 [см. примечание] |
| C (алмаз) | 1800 ® C (графит) |
| CH4 | пл.- 182, кип.- 162 |
| CO | пл.- 205, кип.- 192 |
| CO2 | возг. — 78 |
| Ca | пл. 842, кип. 1495 |
| CaO | пл. ок. 2614, кип. 2850 |
| Cd | пл. 321, кип. 767 |
| CdO | возг. ок. 900, разл. |
| Cl2 | пл.- 101, кип.- 34 |
| ClO2 | пл.- 60, кип. +11 |
| Cl2O | пл.- 116, кип. +2 |
| Cl2O6 | пл. 4, разл. > 20 |
| Cl2O7 | пл.- 90, кип. +83 |
| Сo | пл. 1494, кип. 2960 |
| Cr | пл. 1890, кип. 2680 |
| Cr2O3 | пл. 2340, кип. 3000 |
| Cs | пл. 29, кип. 668 |
| Cu | пл. 1085, кип. 2540 |
| CuO | разл. 1026 |
| Cu2O | пл. 1240, кип. 1800 |
| F2 | пл.- 220, кип.- 188 |
| Fe | пл. 1539, кип. ок. 3200 |
| FeO | пл. 1368 |
| Fe2O3 | разл. 1390 |
| Fr | пл. 21, кип. 660 |
| Ga | пл. 30, кип. 2403 |
| Ga2O3 | пл. ок. 1725 |
| Ge | пл. 937, кип. ок. 2850 |
| GeH4 | пл.- 166, кип.- 89 |
| H2 | пл.- 259, кип.- 253 |
| HBr | пл.- 87, кип.- 67 |
| HCl | пл.- 114, кип.- 85 |
| HF | пл.- 84, кип. +20 |
| HI | пл.- 51, кип.- 35 |
| HN3 | пл.- 80, кип. +36 |
| HNO3 | пл.- 42, кип. +83, разл. |
| H2O | пл. 0, кип. 100 |
| H2O2 | пл.- 0,4, разл. +150 |
| H(PH2O2) | пл. 27, разл. 140 |
| H2(PHO3) | пл. 74, разл. 200 |
| H3PO4 | пл. 42, разл. 150 |
| H4P2O7 | пл. 61, разл. 300 |
| H2S | пл.- 86, кип.- 60 |
| H2SO4 | пл. 10, кип. 296, разл. |
| H2Se | пл.- 66, кип.- 42 |
| H2SeO3 | пл. и разл. 70 |
| H2SeO4 | пл. 62 |
| H2Te | пл.- 51, кип.- 2, разл. |
| H2TeO3 | 40 ® TeO2 |
| H6TeO6 | пл. 136, 220 ® TeO3 |
| Hg | пл.- 39, кип. +357 |
| HgO | разл. > 400 |
| I2 | пл. 114, кип. 184 |
| I2O5 | разл. 275-350 |
| In | пл. 157, кип. 2024 |
| In2O3 | пл. 1910, кип. ок. 3300 |
| K | пл. 64, кип. 760 |
| Li | пл. 180, кип. 1337 |
| Mg | пл. 648, кип. 1095 |
| MgO | пл. 2825, кип. 3600 |
| Mn | пл. 1245, кип. 2080 |
| MnO | пл. 1780 |
| MnO2 | разл. > 535 |
| Mn2O3 | 940 ® (MnIIMn2III)O4 |
| Mn2O7 | пл. 6, разл. > 55 |
| Mo | пл. 2620, кип. 4630 |
| N2 | пл.- 210, кип.- 196 |
| NH3 | пл.- 78, кип.- 33 |
| N2H4 | пл. 2, кип. 114 |
| NH2OH | пл. 32, разл. > 100 |
| NO | пл.- 164, кип.- 152 |
| NO2 | < 21 ® N2O4 |
| N2O | пл.- 91, кип.- 89 |
| N2O3 | кип.- 40, разл. > +5 |
| N2O4 | пл.- 11, кип. 21, разл. |
| N2O5 | пл. 41, разл. |
| Na | пл. 98, кип. 886 |
| Ni | пл. 1455, кип. ок. 2900 |
| NiO | пл. 1955 |
| O2 | пл.- 219, кип.- 183 |
| O3 | пл.- 193, кип.- 112 |
| OF2 | пл.- 224, кип.- 145 |
| P (красный) | возг. 416 |
| P4 (белый) | пл. 44, кип. 287 |
| PH3 | пл.- 134, кип.- 87 |
| P4O6 | пл. 24, кип. 175 |
| P4O10 | возг. 359, пл. 422 |
| Pb | пл. 328, кип. 1745 |
| PbO | пл. 886, кип. 1535 |
| PbO2 | разл. > 344 |
| (Pb2IIPbIV)O4 | 550 ® PbO |
| Ra | пл. 969, кип. 1536 |
| Rb | пл. 39, кип. 696 |
| Re | пл. 3190, кип. ок. 5900 |
| S8 (монокл.) | пл. 119, кип. 445 |
| S8 (ромб.) | 96 ® S8 (монокл.) |
| SO2 | пл.- 75, кип.- 10 |
| SO3 | пл. 17, кип. 45 |
| Sb | пл. 631, кип. 1634 |
| SbH3 | пл. — 94, кип. — 18 |
| Sb2O3 | пл. 655, кип. 1456 |
| Se | пл. 217, кип. 685 |
| SeO2 | возг. 315, пл. 340 |
| SeO3 | пл. 118, разл. > 185 |
| Si | пл. 1415, кип. ок. 3250 |
| SiH4 | пл.- 185, кип.- 112 |
| SiO2 (кварц) | пл. 1550, кип. 2950 |
| Sn | пл. 232, кип. 2620 |
| SnO | пл. 1040, кип. 1425 |
| SnO2 | пл. 1630, кип. 2500 |
| Sr | пл. 768, кип. 1390 |
| Tc | пл. 2250, кип.ок. 4600 |
| Te | пл. 450, кип. 990 |
| TeO2 | пл. 733, кип. 1257 |
| TeO3 | разл. > 400 |
| Ti | пл. 1668, кип. 3260 |
| TiO2 | пл. 1870, кип. ок. 3000 |
| Tl | пл. 304, кип. 1457 |
| Tl2O | пл. 303, кип. ок. 1100 |
| V | пл. 1920, кип. 3450 |
| W | пл. 3387, кип. ок. 5680 |
| Zn | пл. 420, кип. 906 |
| ZnO | возг. 1725, разл. |
Сокращения: возг. — возгонка; кип. — кипение; ок. — около; пл. — плавление; разл. — разложение; ® — переход одного вещества в другое
Примечание: определение температуры плавления графита является очень важной, но очень сложной научной проблемой, которой занимаются во всем мире.
Примечание ко всем таблицам свойств: источниками справочных данных являются публикации в Интернете, поэтому они не могут считаться «официальными» и «абсолютно точными». Как правило, в Интернет справочниках не приводятся ссылки на научные работы, являющиеся основой опубликованных данных.
Мы стараемся брать информацию из наиболее надежных научных сайтов. Однако если кого-то интересуют ссылки на эксперименты, советуем произвести самостоятельно углубленный поиск в Интернете.
Источник:
Таблица температур плавления различных металлов, и при скольки градусах они плавятся Ссылка на основную публикацию